Константин Корсаков 1
Алексей Степанов 2
Лев Поздняков 2
Ольга Якименко 2, *
1 ООО «Лайф Форс Групп» Москва, Россия; korsakovkonstantin@gmail.com
2 Кафедра почвоведения МГУ; iakim@soil.msu.ru
* Для корреспонденции: iakim@soil.msu.ru
Алексей Степанов 2
Лев Поздняков 2
Ольга Якименко 2, *
1 ООО «Лайф Форс Групп» Москва, Россия; korsakovkonstantin@gmail.com
2 Кафедра почвоведения МГУ; iakim@soil.msu.ru
* Для корреспонденции: iakim@soil.msu.ru
Реферат
В рамках модельного лабораторного эксперимента рассмотрены
процессы N-трансформации в почве в зависимости от применения трех видов мочевинных удобрений: традиционной мочевины (U), мочевины с гуматным покрытием (U_HA) и мочевины, обработанной ингибитором уреазы NBPT (U_UI).
Влияние мочевинных удобрений на химические (содержание водоэкстрагируемых N-NH4 и N-NO3) и микробиологические свойства почвы (скорость фактической и потенциальной эмиссии N2O, базальное и субстрат-индуцированное дыхание, микробная биомасса C, эмиссия этилена) направлены на то, чтобы ответить на вопросы: (i) способна ли мочевина, покрытая гуматом , снижать потери азота в почве; и (ii) как она влияет на биологическую активность почвы, в сравнении с синтетическим ингибитором уреазы.
Результаты показали, что U_HA продемонстрировал преимущества, сравнимые с U, в его способности снижать потери азота в почве: он увеличивал содержание N-NH4 на 35%, снижал содержание нитратов на 9% и уменьшал выброс N2O на 50%. U_HA способствовал базальному дыханию почвы на 10% и удельной активности почвенного микробного сообщества на 7%, обеспечивая наивысший метаболический коэффициент qCO2 . По сравнению с U, обработанным NBPT, U_HA в основном показывает промежуточные результаты между U-UI и обычным U. Учитывая низкую стоимость сырьевых гуматов, U-HA можно рассматривать как многообещающее средство для снижения потерь азота в почвах.
процессы N-трансформации в почве в зависимости от применения трех видов мочевинных удобрений: традиционной мочевины (U), мочевины с гуматным покрытием (U_HA) и мочевины, обработанной ингибитором уреазы NBPT (U_UI).
Влияние мочевинных удобрений на химические (содержание водоэкстрагируемых N-NH4 и N-NO3) и микробиологические свойства почвы (скорость фактической и потенциальной эмиссии N2O, базальное и субстрат-индуцированное дыхание, микробная биомасса C, эмиссия этилена) направлены на то, чтобы ответить на вопросы: (i) способна ли мочевина, покрытая гуматом , снижать потери азота в почве; и (ii) как она влияет на биологическую активность почвы, в сравнении с синтетическим ингибитором уреазы.
Результаты показали, что U_HA продемонстрировал преимущества, сравнимые с U, в его способности снижать потери азота в почве: он увеличивал содержание N-NH4 на 35%, снижал содержание нитратов на 9% и уменьшал выброс N2O на 50%. U_HA способствовал базальному дыханию почвы на 10% и удельной активности почвенного микробного сообщества на 7%, обеспечивая наивысший метаболический коэффициент qCO2 . По сравнению с U, обработанным NBPT, U_HA в основном показывает промежуточные результаты между U-UI и обычным U. Учитывая низкую стоимость сырьевых гуматов, U-HA можно рассматривать как многообещающее средство для снижения потерь азота в почвах.
Ключевые слова
гуминовые вещества, гумат калия , леонардит , азотные удобрения , неорганические элементы питания, аммонификация, денитрификация, ингибитор уреазы .
1. Введение
Азот является важным элементом для питания растений, а оптимальное снабжение азотом является ключевым фактором для сельскохозяйственного производства. В глобальном масштабе применение N-удобрений увеличилось с 32 миллионов тонн в год в 1970 году и, как ожидается, достигнет 130-150 миллионов тонн в год к 2050 году [1].
Однако надлежащее управление поступлением азота в систему почва-растение затруднено из-за непродуктивных потерь азота ввиду улетучивания (газообразных потерь в виде аммиака и оксидов азота) и выщелачивания в виде нитрат-ионов.
В современных сельскохозяйственных системах потери азота могут достигать 50–70% от внесенного азота [2–4]. В свою очередь, это приводит к увеличению концентрации NH3 и N2O в атмосфере Земли, что способствует изменению климата, вызываемому парниковыми газами. Вымывание нитратов (NO3–) из наземных экосистем в водные приводит к изменению продуктивности экосистем и биологического разнообразия, эвтрофикации и нитратному загрязнению пресноводных ресурсов.
Мочевина является преобладающей формой азотных удобрений и составляет более половины глобального поступления азота в сельское хозяйство [5]. Таким образом, для нее характерны как самые большие объемы внесения, так и большие непроизводительные потери азота. Химически мочевина представляет собой диамид угольной кислоты (NH2)2CO, содержащий 46% N.
Трансформация мочевины в почве повсеместно описана [6-8]. В почве он быстро подвергается аммонификации: гидролиз, катализируемый почвенным ферментом уреазой, выделяемой микроорганизмами, и разложение с образованием газообразного аммиака и СО2, которые улетучиваются из почвы. В большинстве сельскохозяйственных почв аммонификация происходит в течение нескольких дней в зависимости от влажности почвы, температуры и биологической активности.
Частично мочевина также растворяется в почвенной воде и превращается в карбонат аммония. В свою очередь, образующийся аммоний частично иммобилизуется организмами (растениями и бактериями) и фиксируется органоминеральными компонентами почвы, а частично подвергается нитрификации (окислению NH4+ до NO3-), катализируемой разнообразными почвенными микроорганизмами.
В результате образуются нитриты и нитраты, которые служат источником азота для питания растений. Нитраты, помимо того, что они усваиваются растениями и накапливаются в сельскохозяйственных продуктах, представляют собой плохо связанные с почвой анионы, легко вымываются и стекают в грунтовые воды, вызывая в конечном итоге эвтрофикацию водных ресурсов. Попадая в анаэробные условия (например, внутри почвенных агрегатов), нитраты подвергаются воздействию множества денитрифицирующих почвенных микроорганизмов, которые восстанавливают их до N2 , N2O и других азотсодержащих газов. Денитрификация — еще один способ потери азота, полученного из удобрений.
Одним из современных средств снижения потерь азота является использование синтетических ингибиторов процессов азотного цикла: ингибиторов нитрификации, уреазы и др. В основном такие ингибиторы представляют собой физиологически активные соединения, взаимодействующие с белковыми молекулами ключевых ферментов [9-11]. Они встраиваются в их структуру, либо нарушая работу активного центра, либо вызывая полную денатурацию белка. Таким образом, они угнетают действие ферментов и снижают образование тех соединений азота, которые легко удаляются из почвы: выщелачиваются (в виде селитры) или улетучиваются в виде газов (аммиак, азот и его оксиды).
Однако, несмотря на способность синтетических ингибиторов повышать эффективность использования азота, у них есть много недостатков, включая трудности в применении, стоимость, деградацию, загрязнение и попадание в пищевую систему [12,13]. Таким образом, ингибиторы провоцируют более или менее серьезные нарушения и дисбалансы природного азотного цикла. Многие из этих соединений проявляют неспецифическую активность и способны через различные механизмы нарушать действие ряда ферментов [14], имеются данные об их негативном влиянии на качество пищевой продукции [15, 16].
В качестве альтернативы можно рассмотреть использование ингибиторов природного происхождения [10]. Среди них гуминовые вещества (ГВ), высокомолекулярные природные органические вещества, состоящие из отрицательно заряженного полиэлектролита, содержащего гидрофобное ядро и разнообразные функциональные группы, в том числе хиноновые, альдегидные, карбоксильные, фенольные и спиртовые гидроксилы и эфиры [17].
Они могут действовать как потенциальные ингибиторы уреазы. Возможные механизмы их действия включают химические (фиксация аммония за счет взаимодействия с функциональными группами ГВ) и биохимические процессы (ингибирование ферментов полифенольными компонентами ГВ) [18].
ГВ способны образовывать прочные комплексы с противоположно заряженными белками, что приводит к изменению активности ферментов. Ли и др. [19] сообщили, что ГВ влияют на активность и стабильность уреазы в зависимости от рН, ионной силы и массового соотношения ГВ/фермент. Ли и др. [20] показали ингибирование уреазной активности гуминовыми веществами и предположили, что механизмами ингибирования может быть взаимодействие функциональных групп ГВ с тиоловой группой уреазы и образование более крупного размера частиц комплекса для ингибирования активности уреазы. Наконец, благодаря наличию многочисленных кислотных функциональных групп, обусловливающих высокую обменную способность, ГВ способствуют абиотической фиксации аммиака, что, в свою очередь, снижает улетучивание аммиака и смягчает выщелачивание NO3 и эмиссию N2O, тем самым снижая потери азота [21-22]. При этом большим преимуществом использования ГВ является то, что они могут быть получены с низкими затратами из низкосортного угля и доступны на рынке.
Кроме того, сочетание известных полезных свойств ГВ и неорганических удобрений (мочевины) обеспечивает более сбалансированное питание сельскохозяйственных культур и оптимизацию свойств почвы. Инкапсуляция гранул минеральных удобрений в ГВ-покрытие дает определенные преимущества по сравнению с обычными N-удобрениями. Такие органо-минеральные гранулы поставляют органическое вещество вместе с добавленными питательными веществами, тем самым замедляя немедленное высвобождение питательных веществ из-за повышенной адсорбции органическим веществом и/или иммобилизации питательных веществ микробами. ГВ-покрытие снижает скорость растворения гранул мочевины и, соответственно, замедляет контакт с уреазой. В дальнейших процессах превращений N присутствие ГВ в интерфазах с почвенным микробным сообществом может способствовать увеличению плотности населения почвенных окислителей аммиака [23], способствовать фиксации аммиака и препятствовать образованию нитратов с последующим выщелачиванием и/или улетучиванием в виде оксидов азота и аммиака [24-26]. Также сообщается о положительном влиянии ГВ-мочевины на урожайность [27-33].
Однако интенсивность проявления этих процессов зависит как от почвенно-климатических условий, так и от свойств самих гуматов. В районах с засушливым и жарким климатом, где большая часть осадков выпадает только весной, происходят большие газообразные потери азота удобрений, улетучивающегося в виде аммиака. Это побуждает фермеров использовать повышенные дозы азотных удобрений, что приводит как к более высоким финансовым затратам, так и к ускоренной минерализации органического вещества почвы, истощению почвы и загрязнению окружающей среды.
С другой стороны, в регионах с влажным климатом и большим количеством осадков велики потери азота за счет выщелачивания нитратов и выбросов N2O, которые также сопровождаются выносом органического вещества почвы. Эти процессы также провоцируют фермеров на применение повышенных доз азотных удобрений, что, в свою очередь, приводит к дегумификации почвы, выбросам парниковых газов и общему загрязнению окружающей среды. Поэтому как в засушливых регионах (таких как Средиземноморье, Средняя Азия и Ближний Восток), так и во влажных регионах (таких как север России и Европа) использование карбамида с гуматным покрытием в качестве «зеленой» альтернативы традиционным химикатам кажется особенно многообещающим.
Кроме того, сами ГВ существенно различаются по химическим свойствам и биологической активности в зависимости от происхождения их органического вещества (лигнит, бурый уголь, леонардит, торф, органические сланцы, компост и др.) [34, 35]. Поэтому опытный образец гуматосодержащего удобрения требует предварительного испытания в соответствующих почвенных условиях, чтобы сделать вывод о его эффективности и перспективности использования.
Целью данного исследования было изучение процессов N-трансформации в почве под влиянием применения трех видов мочевинных удобрений: мочевины с гуматным покрытием, мочевины, обработанной ингибитором уреазы, и традиционной мочевины. Исследование проведено в модельном лабораторном опыте, имитирующем весеннее переувлажнение почвы с целью вызвать максимальное вымывание нитратов. Влияние мочевинных удобрений на химические (содержание водоэкстрагируемых N-NH4 и N-NO3, интенсивность фактической и потенциальной эмиссии N2O) и микробиологические свойства почвы (базальное и субстрат-индуцированное дыхание, микробную биомассу C, эмиссию этилена) сосредоточены в ответах на вопросы: (i) имеет ли мочевина, покрытая гуматом, преимущества, сравнимые с обычной мочевиной, в ее способности снижать потери азота в почве; и (ii) как она влияет на биологическую активность почвы, сравнимую с синтетическим ингибитором уреазы.
Однако надлежащее управление поступлением азота в систему почва-растение затруднено из-за непродуктивных потерь азота ввиду улетучивания (газообразных потерь в виде аммиака и оксидов азота) и выщелачивания в виде нитрат-ионов.
В современных сельскохозяйственных системах потери азота могут достигать 50–70% от внесенного азота [2–4]. В свою очередь, это приводит к увеличению концентрации NH3 и N2O в атмосфере Земли, что способствует изменению климата, вызываемому парниковыми газами. Вымывание нитратов (NO3–) из наземных экосистем в водные приводит к изменению продуктивности экосистем и биологического разнообразия, эвтрофикации и нитратному загрязнению пресноводных ресурсов.
Мочевина является преобладающей формой азотных удобрений и составляет более половины глобального поступления азота в сельское хозяйство [5]. Таким образом, для нее характерны как самые большие объемы внесения, так и большие непроизводительные потери азота. Химически мочевина представляет собой диамид угольной кислоты (NH2)2CO, содержащий 46% N.
Трансформация мочевины в почве повсеместно описана [6-8]. В почве он быстро подвергается аммонификации: гидролиз, катализируемый почвенным ферментом уреазой, выделяемой микроорганизмами, и разложение с образованием газообразного аммиака и СО2, которые улетучиваются из почвы. В большинстве сельскохозяйственных почв аммонификация происходит в течение нескольких дней в зависимости от влажности почвы, температуры и биологической активности.
Частично мочевина также растворяется в почвенной воде и превращается в карбонат аммония. В свою очередь, образующийся аммоний частично иммобилизуется организмами (растениями и бактериями) и фиксируется органоминеральными компонентами почвы, а частично подвергается нитрификации (окислению NH4+ до NO3-), катализируемой разнообразными почвенными микроорганизмами.
В результате образуются нитриты и нитраты, которые служат источником азота для питания растений. Нитраты, помимо того, что они усваиваются растениями и накапливаются в сельскохозяйственных продуктах, представляют собой плохо связанные с почвой анионы, легко вымываются и стекают в грунтовые воды, вызывая в конечном итоге эвтрофикацию водных ресурсов. Попадая в анаэробные условия (например, внутри почвенных агрегатов), нитраты подвергаются воздействию множества денитрифицирующих почвенных микроорганизмов, которые восстанавливают их до N2 , N2O и других азотсодержащих газов. Денитрификация — еще один способ потери азота, полученного из удобрений.
Одним из современных средств снижения потерь азота является использование синтетических ингибиторов процессов азотного цикла: ингибиторов нитрификации, уреазы и др. В основном такие ингибиторы представляют собой физиологически активные соединения, взаимодействующие с белковыми молекулами ключевых ферментов [9-11]. Они встраиваются в их структуру, либо нарушая работу активного центра, либо вызывая полную денатурацию белка. Таким образом, они угнетают действие ферментов и снижают образование тех соединений азота, которые легко удаляются из почвы: выщелачиваются (в виде селитры) или улетучиваются в виде газов (аммиак, азот и его оксиды).
Однако, несмотря на способность синтетических ингибиторов повышать эффективность использования азота, у них есть много недостатков, включая трудности в применении, стоимость, деградацию, загрязнение и попадание в пищевую систему [12,13]. Таким образом, ингибиторы провоцируют более или менее серьезные нарушения и дисбалансы природного азотного цикла. Многие из этих соединений проявляют неспецифическую активность и способны через различные механизмы нарушать действие ряда ферментов [14], имеются данные об их негативном влиянии на качество пищевой продукции [15, 16].
В качестве альтернативы можно рассмотреть использование ингибиторов природного происхождения [10]. Среди них гуминовые вещества (ГВ), высокомолекулярные природные органические вещества, состоящие из отрицательно заряженного полиэлектролита, содержащего гидрофобное ядро и разнообразные функциональные группы, в том числе хиноновые, альдегидные, карбоксильные, фенольные и спиртовые гидроксилы и эфиры [17].
Они могут действовать как потенциальные ингибиторы уреазы. Возможные механизмы их действия включают химические (фиксация аммония за счет взаимодействия с функциональными группами ГВ) и биохимические процессы (ингибирование ферментов полифенольными компонентами ГВ) [18].
ГВ способны образовывать прочные комплексы с противоположно заряженными белками, что приводит к изменению активности ферментов. Ли и др. [19] сообщили, что ГВ влияют на активность и стабильность уреазы в зависимости от рН, ионной силы и массового соотношения ГВ/фермент. Ли и др. [20] показали ингибирование уреазной активности гуминовыми веществами и предположили, что механизмами ингибирования может быть взаимодействие функциональных групп ГВ с тиоловой группой уреазы и образование более крупного размера частиц комплекса для ингибирования активности уреазы. Наконец, благодаря наличию многочисленных кислотных функциональных групп, обусловливающих высокую обменную способность, ГВ способствуют абиотической фиксации аммиака, что, в свою очередь, снижает улетучивание аммиака и смягчает выщелачивание NO3 и эмиссию N2O, тем самым снижая потери азота [21-22]. При этом большим преимуществом использования ГВ является то, что они могут быть получены с низкими затратами из низкосортного угля и доступны на рынке.
Кроме того, сочетание известных полезных свойств ГВ и неорганических удобрений (мочевины) обеспечивает более сбалансированное питание сельскохозяйственных культур и оптимизацию свойств почвы. Инкапсуляция гранул минеральных удобрений в ГВ-покрытие дает определенные преимущества по сравнению с обычными N-удобрениями. Такие органо-минеральные гранулы поставляют органическое вещество вместе с добавленными питательными веществами, тем самым замедляя немедленное высвобождение питательных веществ из-за повышенной адсорбции органическим веществом и/или иммобилизации питательных веществ микробами. ГВ-покрытие снижает скорость растворения гранул мочевины и, соответственно, замедляет контакт с уреазой. В дальнейших процессах превращений N присутствие ГВ в интерфазах с почвенным микробным сообществом может способствовать увеличению плотности населения почвенных окислителей аммиака [23], способствовать фиксации аммиака и препятствовать образованию нитратов с последующим выщелачиванием и/или улетучиванием в виде оксидов азота и аммиака [24-26]. Также сообщается о положительном влиянии ГВ-мочевины на урожайность [27-33].
Однако интенсивность проявления этих процессов зависит как от почвенно-климатических условий, так и от свойств самих гуматов. В районах с засушливым и жарким климатом, где большая часть осадков выпадает только весной, происходят большие газообразные потери азота удобрений, улетучивающегося в виде аммиака. Это побуждает фермеров использовать повышенные дозы азотных удобрений, что приводит как к более высоким финансовым затратам, так и к ускоренной минерализации органического вещества почвы, истощению почвы и загрязнению окружающей среды.
С другой стороны, в регионах с влажным климатом и большим количеством осадков велики потери азота за счет выщелачивания нитратов и выбросов N2O, которые также сопровождаются выносом органического вещества почвы. Эти процессы также провоцируют фермеров на применение повышенных доз азотных удобрений, что, в свою очередь, приводит к дегумификации почвы, выбросам парниковых газов и общему загрязнению окружающей среды. Поэтому как в засушливых регионах (таких как Средиземноморье, Средняя Азия и Ближний Восток), так и во влажных регионах (таких как север России и Европа) использование карбамида с гуматным покрытием в качестве «зеленой» альтернативы традиционным химикатам кажется особенно многообещающим.
Кроме того, сами ГВ существенно различаются по химическим свойствам и биологической активности в зависимости от происхождения их органического вещества (лигнит, бурый уголь, леонардит, торф, органические сланцы, компост и др.) [34, 35]. Поэтому опытный образец гуматосодержащего удобрения требует предварительного испытания в соответствующих почвенных условиях, чтобы сделать вывод о его эффективности и перспективности использования.
Целью данного исследования было изучение процессов N-трансформации в почве под влиянием применения трех видов мочевинных удобрений: мочевины с гуматным покрытием, мочевины, обработанной ингибитором уреазы, и традиционной мочевины. Исследование проведено в модельном лабораторном опыте, имитирующем весеннее переувлажнение почвы с целью вызвать максимальное вымывание нитратов. Влияние мочевинных удобрений на химические (содержание водоэкстрагируемых N-NH4 и N-NO3, интенсивность фактической и потенциальной эмиссии N2O) и микробиологические свойства почвы (базальное и субстрат-индуцированное дыхание, микробную биомассу C, эмиссию этилена) сосредоточены в ответах на вопросы: (i) имеет ли мочевина, покрытая гуматом, преимущества, сравнимые с обычной мочевиной, в ее способности снижать потери азота в почве; и (ii) как она влияет на биологическую активность почвы, сравнимую с синтетическим ингибитором уреазы.
2. Материалы и методы
2.1. Материалы
Традиционная мочевина (U), содержащая 46% N, была закуплена у российского производителя и использована в том виде, в каком она была получена. Мочевина, покрытая гуматом (U_HA), была произведена ООО «Лайф Форс Групп» (Россия) и приготовлена следующим образом. Гранулы карбамида помещали в бак-смеситель и обрабатывали жидким 30% гуматом калия, содержащим 20% ГВ (гуминовые и фульвокислоты). Жидкий гумат калия произведен ООО «Лайф Форс Групп» (Россия) методом щелочной экстракции леонардита происхождения из Красноярскго края (Россия). Через форсунку подают раствор гумата, а затем при постоянном перемешивании подают поток подогретого воздуха (85oC ). При последующем охлаждении и сушке нанесенный гумат калия действует как антислеживатель и органический клей, прилипая к гранулам мочевины. Конечный продукт U_HA – гранулы мочевины, инкапсулированные в оболочку из гумата калия и содержащие 2% ГВ.
Чтобы сравнить влияние U_HA на снижение улетучивания аммиака, отдельный образец U обрабатывали ингибитором уреазы (UI), N-(н-бутил) тиофосфорный триамид (NBPT) (Rhodia Operations, Франция) в соответствии с рекомендациями производителя при норме внесения 3,2 литра на 1000 кг мочевины. Для получения мочевины, обработанной UI (U_UI), 4 г U помещали в колбу, добавляли 12,8 мкл NBPT и тщательно перемешивали встряхиванием вручную.
В качестве почвы использовали верхний горизонт окультуренной супесчаной почвы Abruptic Luvisol, отобранной в Калужской области России (54,4293N, 36,5353E) с рН 6,3, 1,76% общего С и 0,18% общего N.
Чтобы сравнить влияние U_HA на снижение улетучивания аммиака, отдельный образец U обрабатывали ингибитором уреазы (UI), N-(н-бутил) тиофосфорный триамид (NBPT) (Rhodia Operations, Франция) в соответствии с рекомендациями производителя при норме внесения 3,2 литра на 1000 кг мочевины. Для получения мочевины, обработанной UI (U_UI), 4 г U помещали в колбу, добавляли 12,8 мкл NBPT и тщательно перемешивали встряхиванием вручную.
В качестве почвы использовали верхний горизонт окультуренной супесчаной почвы Abruptic Luvisol, отобранной в Калужской области России (54,4293N, 36,5353E) с рН 6,3, 1,76% общего С и 0,18% общего N.
2.2. Модельный опыт
Образец почвы с естественной влажностью разминали, удалили крупные корни. Свежую почву просеивали через сито 3 мм и хранили в холодильнике до начала эксперимента (четыре дня). Перед постановкой опыта почву выдерживали 2 часа при комнатной температуре. Образцы свежей невысушенной почвы (200 г) помещали в горшки объемом 300 мл с отверстиями в дне. На дно каждого сосуда предварительно помещали нейлоновый фильтр. Параллельно брали пробы почвы для определения влажности, чтобы привести результаты к безводной основе. Каждая вариант опыта закладывали в 5 повторностях.
Экспериментальные обработки включали контрольную почву (контроль) и почву, обработанную тремя видами мочевины: обычной мочевиной (U), мочевиной, покрытой гуматом (U_HA), и обычной мочевиной, обработанной ингибитором уреазы NBPT (U_UI). Удобрения мочевиной вносили в норме, дающей 0,1803 г N/кг, как это рекомендовано для многих сельскохозяйственных культур. Таким образом, массы U и U_UI (46% N) составляли 0,0780 г/горшок и 0,0795 г/горшок U_HA (2% ГК и 98% мочевины). Гранулы удобрений равномерно размещали на поверхности почвы в горшках. Для имитации условий весеннего переувлажнения на поверхность почвы выливали дистиллированную воду в объеме, несколько превышающем влагоемкость почвы (70 мл), чтобы обеспечить полное проникновение воды и попадание капель на поддон.
Горшки помещали в климатическую камеру Binder KBW400 и выдерживали при 22°С и постоянном освещении в течение 21 дня. На 5, 8 и 15 сутки экспонирования почвы дополнительно увлажняли объемом воды, имитирующим сильный дождь (10 мм осадков), осторожно доливая 50 мл дистиллированной воды. Фиксировали появление капель на поддоне.
На 22-й день почвы извлекали из горшков, гомогенизировали и из каждого горшка отбирали отдельные пробы для определения влажности, химического и микробиологического анализа.
Экспериментальные обработки включали контрольную почву (контроль) и почву, обработанную тремя видами мочевины: обычной мочевиной (U), мочевиной, покрытой гуматом (U_HA), и обычной мочевиной, обработанной ингибитором уреазы NBPT (U_UI). Удобрения мочевиной вносили в норме, дающей 0,1803 г N/кг, как это рекомендовано для многих сельскохозяйственных культур. Таким образом, массы U и U_UI (46% N) составляли 0,0780 г/горшок и 0,0795 г/горшок U_HA (2% ГК и 98% мочевины). Гранулы удобрений равномерно размещали на поверхности почвы в горшках. Для имитации условий весеннего переувлажнения на поверхность почвы выливали дистиллированную воду в объеме, несколько превышающем влагоемкость почвы (70 мл), чтобы обеспечить полное проникновение воды и попадание капель на поддон.
Горшки помещали в климатическую камеру Binder KBW400 и выдерживали при 22°С и постоянном освещении в течение 21 дня. На 5, 8 и 15 сутки экспонирования почвы дополнительно увлажняли объемом воды, имитирующим сильный дождь (10 мм осадков), осторожно доливая 50 мл дистиллированной воды. Фиксировали появление капель на поддоне.
На 22-й день почвы извлекали из горшков, гомогенизировали и из каждого горшка отбирали отдельные пробы для определения влажности, химического и микробиологического анализа.
2.3. Химические анализы
Содержание нитратов и аммония определяли в водных вытяжках (1:2,5) с помощью многоканального иономера Эксперт-001 с ионоселективными электродами ЭКОМ-NH4 и ЭКОМ-NO3. Полученные значения содержания аммония и нитратов были пересчитаны на содержание N. Значения рН определяли в этих же экстрактах с помощью стеклянного электрода. Для анализа использовали образцы исходной влажности, а результаты рассчитывали на безводную основу. Влажность почвы определяли
гравиметрически.
гравиметрически.
2.4. Анализ интенсивности процессов круговорота азота и углерода
После окончания экспонирования и перед отбором проб для химических анализов пробы почвы (5 г) отбирали колонковым пробоотборником и помещали в стеклянные флаконы емкостью 15 мл. Для определения базального дыхания (БД) почвы и фактических потерь азота в виде N2O флаконы закрывали резиновыми крышками и инкубировали в течение 24 часов в термостате при 22 °С. После этого из каждого флакона шприцем отбирали пробу газа (0,25 мл) и определяли концентрации СО2 , С2Н4 и N2О на газовом хроматографе Кристалл 5000.2 (Хроматек, Россия), как описано ниже.
Для определения субстрат-индуцированного дыхания (СИД) в пробы дополнительно добавляли 0,5 мл раствора глюкозы из расчета 2,5 мг глюкозы на 1 г почвы. Затем флаконы закрывали резиновыми пробками и инкубировали 2–3 часа в термостате при 22 °С. Регистрировалось и использовалось в расчетах время инкубации каждой пробы, а также учитывалось начальное содержание СО2 в лабораторном воздухе. Значение СИД пропорционально углероду микробной биомассы, поскольку во время измерения вся биомасса гетеротрофных аэробных микроорганизмов активируется доступным органическим субстратом.
Интенсивность эмиссии N2O измеряли ацетиленовым методом, в котором ацетилен действует как ингибитор редуктазы закиси азота [36]. В присутствии ацетилена C2H2 конечным продуктом денитрификации является N2O, что с высокой точностью можно определить на газовом хроматографе.
Для определения потенциальной эмиссии N2O в пробы почвы во флаконах добавляли KNO3 (0,3 мг/г) и глюкозу (2,5 мг/г), закрывали резиновыми крышками с алюминиевыми зажимами и продували аргоном в течение 2 мин для удаления кислорода. После этого в каждый флакон с помощью шприца добавляли по 1 мл ацетилена, а затем энергично встряхивали вручную для распределения ацетилена по всему объему почвы. Флаконы инкубировали в течение 24 часов в термостате при 22 °С, затем шприцем отбирали пробу газа (0,25 мл). В газовых пробах концентрацию N2O определяли с помощью газового хроматографа Кристалл 5000.2 (Хроматек, Россия).
Газовый хроматограф комплектуется двумя металлическими хроматографическими колонками длиной 2 м и внутренним диаметром 1 мм, заполненными Hayesep-D 80/100. Детектор теплопроводности (TCD) и пламенно-ионизационный детектор (FID) последовательно соединены с одной из колонок для обеспечения измерения CO2, CH4, C2H4, других летучих углеводородов; газ-носитель - гелий. Вторая колонка соединена с детектором захвата электронов (ECD), на котором измеряется N2O; газ-носитель азот.
Для определения субстрат-индуцированного дыхания (СИД) в пробы дополнительно добавляли 0,5 мл раствора глюкозы из расчета 2,5 мг глюкозы на 1 г почвы. Затем флаконы закрывали резиновыми пробками и инкубировали 2–3 часа в термостате при 22 °С. Регистрировалось и использовалось в расчетах время инкубации каждой пробы, а также учитывалось начальное содержание СО2 в лабораторном воздухе. Значение СИД пропорционально углероду микробной биомассы, поскольку во время измерения вся биомасса гетеротрофных аэробных микроорганизмов активируется доступным органическим субстратом.
Интенсивность эмиссии N2O измеряли ацетиленовым методом, в котором ацетилен действует как ингибитор редуктазы закиси азота [36]. В присутствии ацетилена C2H2 конечным продуктом денитрификации является N2O, что с высокой точностью можно определить на газовом хроматографе.
Для определения потенциальной эмиссии N2O в пробы почвы во флаконах добавляли KNO3 (0,3 мг/г) и глюкозу (2,5 мг/г), закрывали резиновыми крышками с алюминиевыми зажимами и продували аргоном в течение 2 мин для удаления кислорода. После этого в каждый флакон с помощью шприца добавляли по 1 мл ацетилена, а затем энергично встряхивали вручную для распределения ацетилена по всему объему почвы. Флаконы инкубировали в течение 24 часов в термостате при 22 °С, затем шприцем отбирали пробу газа (0,25 мл). В газовых пробах концентрацию N2O определяли с помощью газового хроматографа Кристалл 5000.2 (Хроматек, Россия).
Газовый хроматограф комплектуется двумя металлическими хроматографическими колонками длиной 2 м и внутренним диаметром 1 мм, заполненными Hayesep-D 80/100. Детектор теплопроводности (TCD) и пламенно-ионизационный детектор (FID) последовательно соединены с одной из колонок для обеспечения измерения CO2, CH4, C2H4, других летучих углеводородов; газ-носитель - гелий. Вторая колонка соединена с детектором захвата электронов (ECD), на котором измеряется N2O; газ-носитель азот.
2.4.1. Расчет дополнительных параметров состояния почвенных микробных сообществ
Углерод микробной биомассы (Смик) рассчитывали следующим образом [37]:
Для оценки удельной активности почвенного микробного сообщества метаболический коэффициент (qCO2) рассчитывали как отношение БД к Смик и выражали в мг СО2 мкг-1 . Смик ч-1 . Метаболический коэффициент является мерой основного физиологического состояния микробного сообщества и показывает количество углерода, которое образуется на единицу микробной биомассы в час.
Смик (мкг С г-1 ) = СИД (мклCO2 г-1 ч-1 ) • 40,04 + 0,37
Для оценки удельной активности почвенного микробного сообщества метаболический коэффициент (qCO2) рассчитывали как отношение БД к Смик и выражали в мг СО2 мкг-1 . Смик ч-1 . Метаболический коэффициент является мерой основного физиологического состояния микробного сообщества и показывает количество углерода, которое образуется на единицу микробной биомассы в час.
2.5. Статистика
Все измерения проводились в пятикратной повторности. Для статистического анализа использовали пакет программ Statistica 10. Все зарегистрированные значения даны как среднее значение ± стандартное отклонение. Для каждой группы анализов, чтобы определить значимость различий, различия сравнивали с использованием однофакторного дисперсионного анализа (ANOVA). Тест Фишера на ЛСД использовался для выявления различий между методами обработок. Все тесты на значимость проводились при P < 0,05.
3. Результаты
3.1. Содержание N-NH4 , N-NO3 и рН почвы
Исходная необработанная почва очень бедна аммонием (менее 1 ppm N-NH4), а внесение 180 ppm азота с мочевинными удобрениями резко повысило содержание водорастворимого N-NH4 в почве (рис.1а). Традиционная мочевина увеличивала содержание N-NH4 до 2,3 мг/кг, а покрытая гуматом мочевина — до 3,5 мг/кг. Максимальное накопление аммония, как и ожидалось, наблюдалось при обработке ингибитором уреазы. Ингибируя действие фермента, UI снижает разложение мочевины и, соответственно, потери азота в виде газообразного NH3 . В результате азот мочевины полнее превращается в NH4+ и связывается с компонентами почвы.

Рисунок 1.
Влияние мочевинных удобрений на содержание водорастворимых N-NH4 (A), N-NO3 (B) и рН (C). Сокращения: контрольная почва (Контроль), почва, обработанная традиционной мочевиной (U), гуматизированная мочевина, покрытая оболочкой из гумата (U_HA), традиционная мочевина с ингибитором уреазы (U_UI). Значения приведены как среднее значение ± стандартное отклонение. Разные буквы обозначают статистически значимые различия между обработками (p < 0,05) по данным ЛСД-теста.
Влияние мочевинных удобрений на содержание водорастворимых N-NH4 (A), N-NO3 (B) и рН (C). Сокращения: контрольная почва (Контроль), почва, обработанная традиционной мочевиной (U), гуматизированная мочевина, покрытая оболочкой из гумата (U_HA), традиционная мочевина с ингибитором уреазы (U_UI). Значения приведены как среднее значение ± стандартное отклонение. Разные буквы обозначают статистически значимые различия между обработками (p < 0,05) по данным ЛСД-теста.
Благодаря интенсивному процессу нитрификации, происходившему в ходе эксперимента, большая часть внесенного азота превратилась в нитраты (см. табл. 1). В абсолютных значениях содержание N-NO3 в водных вытяжках было самым высоким при обработке традиционной мочевиной и меньшим в ряду U_HA – U_UI (рис.1б). По данным ЛСД-теста статистически подтверждено меньшее накопление нитратов при обработках U_HA и U_UI по сравнению с традиционной мочевиной, тогда как значения U_HA и U_UI между собой не различаются.
Активная трансформация N-NH4+ в нитраты нитрифицирующими микроорганизмами приводила к снижению рН почвы на 0,2-0,5 ед. во всех обработках мочевиной по сравнению с контролем (рис. 1в). Этот эффект наиболее ярко проявлялся при обработке традиционной мочевиной, тогда как применение U_HA и особенно U_ UI способствовало меньшему повышению кислотности почвы.
Активная трансформация N-NH4+ в нитраты нитрифицирующими микроорганизмами приводила к снижению рН почвы на 0,2-0,5 ед. во всех обработках мочевиной по сравнению с контролем (рис. 1в). Этот эффект наиболее ярко проявлялся при обработке традиционной мочевиной, тогда как применение U_HA и особенно U_ UI способствовало меньшему повышению кислотности почвы.
3.2. Потери газообразного азота
В этом опыте интенсивно проявлялись процессы аммонификации и нитрификации в почве, большая часть внесенного азота накапливалась в виде нитратов. Поэтому наиболее существенным источником потерь N является эмиссия N2O, вызванная деятельностью микробных денитрификаторов.
При применении мочевины ожидаемо происходит значительное увеличение газообразных потерь азота в виде монооксида азота N2O (рис. 2а). Среди всех образцов, обработанных мочевиной, самая низкая эмиссия N2O наблюдалась для обработки U_HA: на 50% меньше по сравнению с традиционной мочевиной, и различия статистически значимы.
Что касается потенциальной денитрифицирующей активности, то все мочевинные удобрения снижали ее примерно на 30% (рис. 2б). Это результат изменения почвенных условий и характера микробной сукцессии за 22 дня эксперимента. Поскольку различий между U_HA и U_UI и традиционной мочевиной не наблюдается, можно сделать вывод, что даже в наиболее благоприятных для денитрификации условиях мочевина, покрытая гуматом, не вызывает повышенных выбросов N2O (парникового газа) в атмосферу. В естественных условиях фактические выбросы N2 O, вероятно, будут значительно ниже, чем при использовании традиционной мочевины или мочевины в сочетании с ингибиторами уреазы.
При применении мочевины ожидаемо происходит значительное увеличение газообразных потерь азота в виде монооксида азота N2O (рис. 2а). Среди всех образцов, обработанных мочевиной, самая низкая эмиссия N2O наблюдалась для обработки U_HA: на 50% меньше по сравнению с традиционной мочевиной, и различия статистически значимы.
Что касается потенциальной денитрифицирующей активности, то все мочевинные удобрения снижали ее примерно на 30% (рис. 2б). Это результат изменения почвенных условий и характера микробной сукцессии за 22 дня эксперимента. Поскольку различий между U_HA и U_UI и традиционной мочевиной не наблюдается, можно сделать вывод, что даже в наиболее благоприятных для денитрификации условиях мочевина, покрытая гуматом, не вызывает повышенных выбросов N2O (парникового газа) в атмосферу. В естественных условиях фактические выбросы N2 O, вероятно, будут значительно ниже, чем при использовании традиционной мочевины или мочевины в сочетании с ингибиторами уреазы.

Рисунок 2.
Влияние мочевинных удобрений на фактическую (A) и потенциальную (B) интенсивность выбросов N2O. Сокращения: контрольная почва (Контроль), почва, обработанная традиционной мочевиной (U), мочевина, покрытая гуматом (U_HA), традиционная мочевина с ингибитором уреазы (U_UI). Значения приведены как среднее ± SD. Разные буквы обозначают статистически значимые различия между обработками (p < 0,05) по данным ЛСД-теста.
Влияние мочевинных удобрений на фактическую (A) и потенциальную (B) интенсивность выбросов N2O. Сокращения: контрольная почва (Контроль), почва, обработанная традиционной мочевиной (U), мочевина, покрытая гуматом (U_HA), традиционная мочевина с ингибитором уреазы (U_UI). Значения приведены как среднее ± SD. Разные буквы обозначают статистически значимые различия между обработками (p < 0,05) по данным ЛСД-теста.
3.3. Активность почвенного микробного сообщества
Внесение минеральных удобрений неизбежно влечет за собой глубокие изменения уровня биологической активности почвы, что сказывается на процессах и скорости биохимической трансформации биофильных элементов. В этом опыте применение всех испытанных мочевинных удобрений привело к снижению выбросов углекислого газа (базового дыхания) с 468 в контроле до 343-395 нг С-СО2г-1ч-1 (рис. 2а). Традиционная мочевина обеспечивала наибольшее проявление этого эффекта, тогда как присутствие ингибитора уреазы и гуматного покрытия несколько смягчало этот эффект.
Снижение БД также связано со снижением рН почвы, которое происходит при внесении мочевины (рис. 1в). Наибольшее повышение уровня кислотности наблюдалось при обработке U. Это, в свою очередь, вызывало и наиболее значительное снижение БР, тогда как при применении U_HA и особенно U_UI микробная активность подавлялась в меньшей степени. В результате активность почвенного микробного сообщества (выраженная в БД) в U_HA была выше по сравнению с обычным U и такой же, как в U_UI.
Снижение БД также связано со снижением рН почвы, которое происходит при внесении мочевины (рис. 1в). Наибольшее повышение уровня кислотности наблюдалось при обработке U. Это, в свою очередь, вызывало и наиболее значительное снижение БР, тогда как при применении U_HA и особенно U_UI микробная активность подавлялась в меньшей степени. В результате активность почвенного микробного сообщества (выраженная в БД) в U_HA была выше по сравнению с обычным U и такой же, как в U_UI.


Рисунок 3.
Влияние мочевинных удобрений на базальное дыхание почвы (А), микробную биомассу С (B), метаболический коэффициент qCO2 (С) и скорость выделения этилена (D). Сокращения: контрольная почва (Контроль), почва, обработанная обычной мочевиной (U), мочевина, покрытая гуматом (U_HA), обычная мочевина с ингибитором уреазы (U_UI). Значения даны как среднее ± стандартное отклонение. Разные буквы обозначают статистически значимые различия между обработками (p < 0,05) по данным ЛСД-теста.
Влияние мочевинных удобрений на базальное дыхание почвы (А), микробную биомассу С (B), метаболический коэффициент qCO2 (С) и скорость выделения этилена (D). Сокращения: контрольная почва (Контроль), почва, обработанная обычной мочевиной (U), мочевина, покрытая гуматом (U_HA), обычная мочевина с ингибитором уреазы (U_UI). Значения даны как среднее ± стандартное отклонение. Разные буквы обозначают статистически значимые различия между обработками (p < 0,05) по данным ЛСД-теста.
Количество почвенной микробной биомассы С было ниже во всех образцах с обработанной мочевиной, по сравнению с контролем (рис. 3б) , скорее всего, в результате усиления конкуренции за доступные источники углерода при обеспечении азотного питания.
Помимо самой биомассы важной качественной характеристикой, отражающей состояние и удельную активность почвенного микробного сообщества, является микробный метаболический коэффициент (отношение дыхания к биомассе), или qCO2 . В нашем эксперименте значения qCO2 колебались в пределах 0,72-0,77 мкг CO2 мг-1 Cmic h-1 (рис. 3c). Хотя различия между обработками не являются статистически значимыми, на уровне тренда заметно снижение qCO2 под влиянием традиционной U и U_UI. С другой стороны, при применении мочевины, покрытой гуматом, уровень функциональной активности микробной биомассы сохраняется на уровне контрольных значений.
Исходная почва характеризуется эмиссией этилена на уровне 40 нг C-C2H4 г-1 ч-1 (рис. 3г). Этилен известен как один из важнейших фитогормонов, и даже в низких концентрациях он оказывает значительное влияние на рост и развитие растений. Согласно Аршаду и Франкенбергеру [38], почвенные грибы и бактерии также производят достаточно C2 H4 для запуска физиологических реакций. Однако мало что известно о конкретных механизмах, лежащих в основе этилен-опосредованного взаимодействия почвенных микроорганизмов и растений. В то время как аммонийные формы N не влияют и даже не усиливают синтез этилена в почвах, известно, что нитраты оказывают на него губительное влияние [39]. В нашем опыте мы не наблюдали зависимости эмиссии этилена от концентрации нитратов, однако, следует отметить, что под влиянием мочевины, покрытой гуматом, и ингибитора уреазы эмиссия этилена снижается вдвое по сравнению с контролем.
Помимо самой биомассы важной качественной характеристикой, отражающей состояние и удельную активность почвенного микробного сообщества, является микробный метаболический коэффициент (отношение дыхания к биомассе), или qCO2 . В нашем эксперименте значения qCO2 колебались в пределах 0,72-0,77 мкг CO2 мг-1 Cmic h-1 (рис. 3c). Хотя различия между обработками не являются статистически значимыми, на уровне тренда заметно снижение qCO2 под влиянием традиционной U и U_UI. С другой стороны, при применении мочевины, покрытой гуматом, уровень функциональной активности микробной биомассы сохраняется на уровне контрольных значений.
Исходная почва характеризуется эмиссией этилена на уровне 40 нг C-C2H4 г-1 ч-1 (рис. 3г). Этилен известен как один из важнейших фитогормонов, и даже в низких концентрациях он оказывает значительное влияние на рост и развитие растений. Согласно Аршаду и Франкенбергеру [38], почвенные грибы и бактерии также производят достаточно C2 H4 для запуска физиологических реакций. Однако мало что известно о конкретных механизмах, лежащих в основе этилен-опосредованного взаимодействия почвенных микроорганизмов и растений. В то время как аммонийные формы N не влияют и даже не усиливают синтез этилена в почвах, известно, что нитраты оказывают на него губительное влияние [39]. В нашем опыте мы не наблюдали зависимости эмиссии этилена от концентрации нитратов, однако, следует отметить, что под влиянием мочевины, покрытой гуматом, и ингибитора уреазы эмиссия этилена снижается вдвое по сравнению с контролем.
4. Обсуждения
В этом опыте мы изучили трансформацию азота в почве под влиянием трех видов мочевинных удобрений: традиционной мочевины, мочевины, покрытой гуматом, и мочевины в сочетании с ингибитором уреазы. В данных экспериментальных условиях накопление N-NH4 и снижение образования N-NO3 наблюдались в последних двух обработках, сравниваемых с традиционной мочевиной.
Представление полученных данных в процентах от внесенного азота дает более четкое представление о происходящих процессах (табл. 1). Фиксация аммиака усиливается в присутствии HA-покрытия, о чем свидетельствует увеличение содержания водоэкстрагируемого NH4+ . Хотя этот эффект менее выражен по сравнению с обработкой ингибитором уреазы, но однозначно показывает положительную динамику.
Представление полученных данных в процентах от внесенного азота дает более четкое представление о происходящих процессах (табл. 1). Фиксация аммиака усиливается в присутствии HA-покрытия, о чем свидетельствует увеличение содержания водоэкстрагируемого NH4+ . Хотя этот эффект менее выражен по сравнению с обработкой ингибитором уреазы, но однозначно показывает положительную динамику.
Таблица 1.
Влияние карбамидных удобрений на содержание N-NH4 , N-NO3 (нормировано на количество внесенного N); и фактический уровень выбросов N2O (в % обработанной мочевиной почвы)
Влияние карбамидных удобрений на содержание N-NH4 , N-NO3 (нормировано на количество внесенного N); и фактический уровень выбросов N2O (в % обработанной мочевиной почвы)
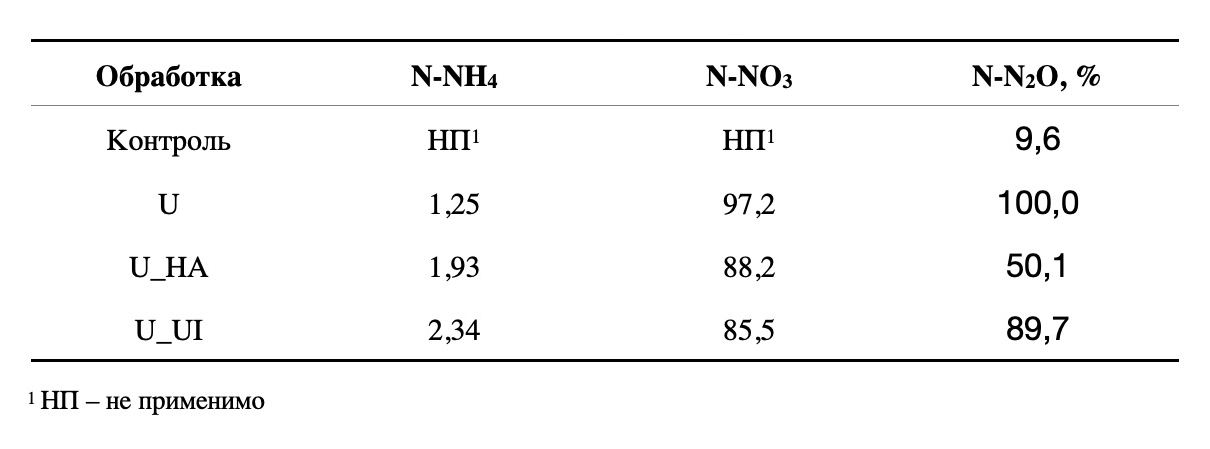
В почве мочевина быстро подвергается процессу нитрификации с образованием иона нитрата. Скорость нитрификации зависит от влажности почвы, содержания элементов питания и биологической активности почвы. В нашем опыте исходные почвенные условия были благоприятны для нитрификации, и 86-97% внесенного азота превращалось в нитраты (табл. 1). Наибольшая доля нитратов выявлена при обработке традиционной мочевиной (97%), тогда как при обработке U_HA доля нитратов была близка к таковой при обработке ингибитором уреазы (88% и 86% соответственно). Этот факт свидетельствует о снижении скорости нитрификации под влиянием покрытой гуматом мочевины.
Фактический уровень выбросов N2O, выраженный в процентах от обработанной мочевиной почвы, резко снизился при обработке U_HA по сравнению с традиционной мочевиной (таблица 1). Потери газообразного азота достигли минимального значения, даже меньше, чем при обработке ингибитором уреазы. Аналогичная ситуация будет наблюдаться для большинства природных условий.
Все вышеизложенное подтверждает гипотезу о том, что ГК-покрытие мочевины действует аналогично природному ингибитору нитрификации. Мы считаем это тенденцией к стабилизации пула вносимого аммония и снижению скорости его окисления до нитратов с последующим выносом последних с почвенным стоком и газообразными потерями. В условиях нашего эксперимента эта закономерность выражена в виде тренда. Можно предположить, что в почвах с меньшей биологической активностью, таких как песчаные или малогумусовые, эта закономерность может проявляться более отчетливо.
Кроме того, имеет значение концентрация ГК на гранулах мочевины, так как скорость ингибирования уреазной активности положительно коррелирует с долей добавленной ГК. По литературным данным, оптимальная доля ГК в гуматизированной мочевине может варьировать от 0,2 до 15% [40-43]. Некоторые исследования показали, что мочевина, смешанная с бурым углем с высоким содержанием ГК, может минимизировать потери минерального азота за счет увеличения доли бурого угля до 65% [44-45]. В то же время следует иметь в виду, что ГК оказывает стимулирующее действие на рост растений при 50–500 мг/кг , а ингибирующее — при 1000–4000 мг/кг [34, 46, 47], поэтому оптимальную норму ГК на мочевину следует исследовать.
Все испытанные мочевинные удобрения влияли и на микробиологическую активность почвы. Базальное микробное дыхание уменьшилось на 14-23% по сравнению с контролем (табл. 2). Эти изменения должны быть связаны с уменьшением микробной биомассы, вызванным последовательным изменением состава микробного сообщества, а также усилением конкуренции за легкодоступные органические субстраты. Измерения биомассы использовались для раннего определения изменений в содержании органического вещества в почвах из-за изменений в управлении почвой [48, 49]. Мочевину, покрытая гуматом, можно считать более щадящим для функционирования микробных сообществ и благоприятным для стабилизации органического вещества почвы, так как в этом варианте наблюдалось меньшее снижение биомассы и базального дыхания, а также отсутствие изменения метаболического коэффициента по сравнению с контролем. В дальнейших исследованиях следует также обратить внимание на усиленное подавление скорости выделения этилена из почвы при использовании гуматизированной мочевины и ингибитора уреазы. Хотя этилен не является парниковым газом, он является важным физиологически активным веществом, и увеличение его концентрации в поровом пространстве почвы и приповерхностном слое атмосферы может сказаться на росте и развитии культурных растений и, в конечном счете, урожайности.
Фактический уровень выбросов N2O, выраженный в процентах от обработанной мочевиной почвы, резко снизился при обработке U_HA по сравнению с традиционной мочевиной (таблица 1). Потери газообразного азота достигли минимального значения, даже меньше, чем при обработке ингибитором уреазы. Аналогичная ситуация будет наблюдаться для большинства природных условий.
Все вышеизложенное подтверждает гипотезу о том, что ГК-покрытие мочевины действует аналогично природному ингибитору нитрификации. Мы считаем это тенденцией к стабилизации пула вносимого аммония и снижению скорости его окисления до нитратов с последующим выносом последних с почвенным стоком и газообразными потерями. В условиях нашего эксперимента эта закономерность выражена в виде тренда. Можно предположить, что в почвах с меньшей биологической активностью, таких как песчаные или малогумусовые, эта закономерность может проявляться более отчетливо.
Кроме того, имеет значение концентрация ГК на гранулах мочевины, так как скорость ингибирования уреазной активности положительно коррелирует с долей добавленной ГК. По литературным данным, оптимальная доля ГК в гуматизированной мочевине может варьировать от 0,2 до 15% [40-43]. Некоторые исследования показали, что мочевина, смешанная с бурым углем с высоким содержанием ГК, может минимизировать потери минерального азота за счет увеличения доли бурого угля до 65% [44-45]. В то же время следует иметь в виду, что ГК оказывает стимулирующее действие на рост растений при 50–500 мг/кг , а ингибирующее — при 1000–4000 мг/кг [34, 46, 47], поэтому оптимальную норму ГК на мочевину следует исследовать.
Все испытанные мочевинные удобрения влияли и на микробиологическую активность почвы. Базальное микробное дыхание уменьшилось на 14-23% по сравнению с контролем (табл. 2). Эти изменения должны быть связаны с уменьшением микробной биомассы, вызванным последовательным изменением состава микробного сообщества, а также усилением конкуренции за легкодоступные органические субстраты. Измерения биомассы использовались для раннего определения изменений в содержании органического вещества в почвах из-за изменений в управлении почвой [48, 49]. Мочевину, покрытая гуматом, можно считать более щадящим для функционирования микробных сообществ и благоприятным для стабилизации органического вещества почвы, так как в этом варианте наблюдалось меньшее снижение биомассы и базального дыхания, а также отсутствие изменения метаболического коэффициента по сравнению с контролем. В дальнейших исследованиях следует также обратить внимание на усиленное подавление скорости выделения этилена из почвы при использовании гуматизированной мочевины и ингибитора уреазы. Хотя этилен не является парниковым газом, он является важным физиологически активным веществом, и увеличение его концентрации в поровом пространстве почвы и приповерхностном слое атмосферы может сказаться на росте и развитии культурных растений и, в конечном счете, урожайности.
Таблица 2.
Влияние карбамидных удобрений на микробиологические показатели почвы, % к контролю
Влияние карбамидных удобрений на микробиологические показатели почвы, % к контролю

5. Выводы
В нашем эксперименте мочевина, покрытая гуматом, продемонстрировала определенные преимущества по сравнению с традиционной мочевиной в ее способности снижать потери азота в почве. Она способствовал абиотической фиксации аммиака, предотвращал подкисление почвы, вызванное мочевиной, уменьшал нитрификацию и выбросы N2O. Микробная биомасса также оставалась более стабильной, а ее функционирование было менее нарушено.
Примечательно, что эти эффекты, помимо сельскохозяйственных достоинств, имеют еще и экологическое значение. Выбросы аммиака и оксида азота приводят не только к непроизводительным потерям азота удобрений, но и влекут за собой неблагоприятные экологические последствия, способствуя глобальному парниковому эффекту.
По сравнению с карбамидом, обработанным NBPT, карбамид, покрытый гуматом, в основном показывает промежуточные результаты между U-UI и традиционной U. В то же время некоторые показатели биологической активности почвы показали потенциальное негативное влияние NBPT на почвенную биоту. Таким образом, более низкий метаболический коэффициент qCO2 по сравнению с U_HA и контрольной почвой свидетельствует о возможном неспецифическом негативном влиянии ингибитора уреазы на другие функции почвенной биоты. Учитывая тот факт, что эффекты U_HA имеют ту же тенденцию, что и у U_UI, и учитывая низкую стоимость сырьевых гуматов, его использование может быть экономически целесообразным.
Однако необходимо учитывать, что наблюдаемые тенденции справедливы для условий данного эксперимента. Культивируемый Abruptic Luvisol, использованный в нашем эксперименте, характеризовался высоким уровнем биологической активности и нейтральным рН; инкубацию проводили при 22°С при постоянном освещении. Можно предположить, что в других условиях эксперимента, при других концентрациях ГК или в других почвенно-биоклиматических условиях выявленные закономерности могут быть более выраженными. Целесообразно проведение дальнейших исследований по этому вопросу для различных почв. Таким образом, в засушливых районах с малогумусированными песчаными почвами и интенсивным улетучиванием NH3 гуминовое покрытие на поверхности гранул мочевины может не только действовать как ингибитор уреазы, но и улучшать гумусное состояние почвы. Во влажных регионах, подверженных интенсивному выщелачиванию нитратов и активной эмиссии N2O, мочевина, покрытая гуматом, также будет способствовать уменьшению проявления этих негативных эффектов. Несмотря на то, что его действие менее выражено по сравнению с синтетическим ингибитором уреазы, использование таких продуктов можно считать средством снижения химических нагрузок в сельском хозяйстве и шагом к «зеленому» земледелию.
Примечательно, что эти эффекты, помимо сельскохозяйственных достоинств, имеют еще и экологическое значение. Выбросы аммиака и оксида азота приводят не только к непроизводительным потерям азота удобрений, но и влекут за собой неблагоприятные экологические последствия, способствуя глобальному парниковому эффекту.
По сравнению с карбамидом, обработанным NBPT, карбамид, покрытый гуматом, в основном показывает промежуточные результаты между U-UI и традиционной U. В то же время некоторые показатели биологической активности почвы показали потенциальное негативное влияние NBPT на почвенную биоту. Таким образом, более низкий метаболический коэффициент qCO2 по сравнению с U_HA и контрольной почвой свидетельствует о возможном неспецифическом негативном влиянии ингибитора уреазы на другие функции почвенной биоты. Учитывая тот факт, что эффекты U_HA имеют ту же тенденцию, что и у U_UI, и учитывая низкую стоимость сырьевых гуматов, его использование может быть экономически целесообразным.
Однако необходимо учитывать, что наблюдаемые тенденции справедливы для условий данного эксперимента. Культивируемый Abruptic Luvisol, использованный в нашем эксперименте, характеризовался высоким уровнем биологической активности и нейтральным рН; инкубацию проводили при 22°С при постоянном освещении. Можно предположить, что в других условиях эксперимента, при других концентрациях ГК или в других почвенно-биоклиматических условиях выявленные закономерности могут быть более выраженными. Целесообразно проведение дальнейших исследований по этому вопросу для различных почв. Таким образом, в засушливых районах с малогумусированными песчаными почвами и интенсивным улетучиванием NH3 гуминовое покрытие на поверхности гранул мочевины может не только действовать как ингибитор уреазы, но и улучшать гумусное состояние почвы. Во влажных регионах, подверженных интенсивному выщелачиванию нитратов и активной эмиссии N2O, мочевина, покрытая гуматом, также будет способствовать уменьшению проявления этих негативных эффектов. Несмотря на то, что его действие менее выражено по сравнению с синтетическим ингибитором уреазы, использование таких продуктов можно считать средством снижения химических нагрузок в сельском хозяйстве и шагом к «зеленому» земледелию.
Вклад авторов:
Концептуализация. К.К. , О.Я. и АС; методология. О.Я. А.С.; исследование. Л.П. и О.Я .; написание — подготовка первоначального проекта. О.Я., А.С. и Л.П.; написание - обзор и редактирование. О.Я. , А.С. и Л.П.; приобретение финансирования. KK Все авторы прочитали и согласились с опубликованной версией рукописи.
Концептуализация. К.К. , О.Я. и АС; методология. О.Я. А.С.; исследование. Л.П. и О.Я .; написание — подготовка первоначального проекта. О.Я., А.С. и Л.П.; написание - обзор и редактирование. О.Я. , А.С. и Л.П.; приобретение финансирования. KK Все авторы прочитали и согласились с опубликованной версией рукописи.
